研究内容
脳には未知の部分がたくさんあり、領域や方法など研究の自由度は大きいものがあります。私たちは「神経活動と脳代謝の相互関係」という視点から脳機能を総合的に捉えていきたいと考え、独自の技術を開発しながら研究を進めています。
【グルコースの細胞内への取り込みの蛍光グルコースイメージングによる解析 】
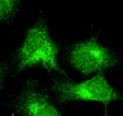
蛍光グルコースを取り込んで光る細胞
脳活動のエネルギー源はもっぱらグルコースに依存していることはどの教科書にも書かれよく知られています。しかし脳には多様な細胞があり、複雑に絡み合うように存在するため、グルコースの細胞間のやり取りなど動的研究をするには困難がありました。特に血管から脳内に入ったグルコースが神経細胞により直接利用されているかどうかはよくわかりません。
これに対して私たちはまず、蛍光標識グルコース2-NBDGがグルコース同様のキネティクスで哺乳類のグルコーストランスポーターを介して細胞内に取り込まれることを示し、生きた哺乳動物細胞のグルコース取り込みのイメージングが初めて単一細胞レベルで行えるようになりました(Yamada, K. 他、J. Biol. Chem. 2000; Yamada, K..他、Nature Protocols 2007)。
この手法は全身の多様な細胞に応用され、特に最近脳では神経活動にリンクしたグルコース利用の様子やグリア細胞のギャップ結合を介するグルコースの拡散などが蛍光グルコースを用いて報告され、ホットな議論を引き起こしています。また血管からアストロサイトに入ったグルコースが、アストロサイト内で乳酸に変換された上、神経細胞に分泌されてエネルギーとして利用されるという有名な説があります。この説の真偽を調べる目的でも蛍光グルコースが使われ、注目されています。
一方、本法には蛍光法独特のさまざまな技術的課題も含まれています。そこで私たちは、現在の蛍光グルコース法を新しい次元に進める研究も行っており、それにより脳やさまざまな臓器・細胞のグルコース輸送動態の解明に役立てることができればと考えています。
【 神経活動依存的脳血管調節機構の研究 】

リアルタイムレーザー共焦点顕微鏡
脳内で神経活動が起きる時、神経興奮領域では局所的に酸素消費がおこり、それに応じて脳血流も局所的に増大することが古くからから知られていました。この原理はPETのようなヒトの非侵襲的脳機能計測法に利用されて、脳機能の理解に役立っています。しかし神経活動がどのような仕組みで血流増大を引き起こすのか、その仕組みの詳細は分かっていません。特に神経活動の現場である脳表面から内部に向かって伸び、血流調節の主役の役目を果たしている細動脈の動態についてはあまりわかっていません。
これまで私達は、脳酸素消費と血流増加の時間的関係について光学的内因性信号記録とレーザードップラー法の初めての同時計測や (Dov, M. 他、Proc. Natl. Acad. Sci. USA, 1997)、これに神経活動計測を加えた3者同時計測により調べてきました(Fujita, H. 他、J . Neurosci. Methods 2000) 。
そこでこれらの方法を応用し、神経活動依存的脳血管調節と血管平滑筋型KATPチャネルとの関係について調べる研究をおこなっています。また遺伝子導入により脳の血管を光らせた上、リアルタイム3次元レーザー共焦点顕微鏡を用いて神経活動時の血管変化を調べる研究にも着手し、血流調節の主役とされる細動脈などの動態を詳しく調べています。
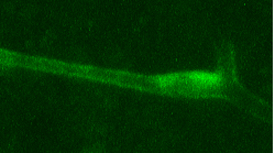
リアルタイム共焦点顕微鏡による脳内血管イメージング
【 脳の低酸素センサーの研究 】
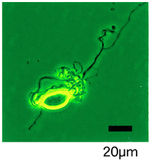
急性単離した中脳黒質網様部ニューロン
脳が虚血や低酸素状態など、強いメタボリックストレス状態に陥ると、細胞内のATP濃度が低下します。このとき中脳の黒質網様部と呼ばれる領域で、普段は閉じているATP感受性カリウム(KATP)チャネルと呼ばれる分子(カリウムイオンを通す穴)が開くことで脳が異常興奮(generalized
seizure)するのを防いでいることが、遺伝子欠損マウスを用いた単一チャネル、細胞、組織、個体レベルの実験からわかりました(Yamada, K. 他、Science 2001)。
本チャネルは正確にはKir6.2とSUR1という二種類のサブユニットから形成される膵臓β細胞型KATPチャネルと呼ばれるものです。私たちはKir6.2の遺伝子を欠失させたマウスを解析に用いましたが、SUR1の遺伝子を欠失させた場合にも同様の現象が起きることが後に報告されました。また同遺伝子を過剰に発現させたマウスでは、脳の異常興奮が正常マウスよりおきにくくなるという報告もなされています(Hernandez-Sanchez,
C. et al, PNAS 2001)。このように膵臓β細胞型KATPチャネルの脳における働きのひとつは、脳を異常興奮から守ることにあるようです。
一方、中脳の黒質網様部の神経細胞は脳内で最も高頻度の自発的な神経発火活動を示すことで知られていますが、同時にKATPチャネルも高濃度に発現しています。黒質細胞は酸素低下を、その発火頻度の変化により鋭敏に感知することがわかりましたが、このような役割がなぜ黒質に与えられたのか、運動制御機能や中枢への情報還流機能をもつ黒質の神経回路上の意義から興味深いものがあります(Yamada, K. 他、News Physiol. Sci. 2002)。
最近、KATPチャネルが呼吸制御に関係していることを示す結果も得られました(Miyake A 他 Eur J Neurosci 2007)。意識を喪失するほどの低酸素に陥った時や、出生の瞬間、また臨終の際の低酸素状態においては、あえぎ呼吸(gasping)と呼ばれる原始的な呼吸が現れ、脳波が消失して大脳皮質の活動が停止した状態でなおかつ最低限のガス交換を維持する役目を果たすと考えられていますが、その詳細や分子機序はよくわかっていませんでした。
Kir6.2欠損マウスを低酸素環境においたところ、あえぎ呼吸をうまく持続できないことがわかり、更にあえぎ呼吸の維持に中枢にある膵β細胞型KATPチャネルが重要な役目を果たしていることが示唆されました。実際Kir6.2によく似たサブユニットKir6.1を欠失させたマウスではあえぎ呼吸の異常は見られないことから、Kir6.2を含有するKATPチャネルは脳の低酸素センサーとして酸素低下時の生体防御に様々な形で寄与しているようです(参考文献 Yamada, K. 他、J Mol Cell Cardiol 2005)。
【 脳の低グルコースセンサーの研究 】
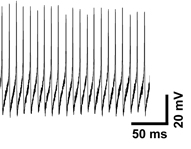
高頻度の発火活動を示す中脳黒質網様部ニューロン
脳活動を支える唯一のエネルギー源はグルコースである為、グルコースの低下は脳活動に致命的な影響を及ぼします。しかし脳がグルコース濃度の低下を感知する仕組みは良くわかっていません。私たちは黒質(網様部)の低酸素センサーとしての性質を調べているとき、偶然にも黒質網様部ニューロンの半数以上がグルコースのわずかな低下に応答して自発発火活動を増大させる性質をもつことがわかりました(Yuan, H他 Neurosci Lett 2004a)。
このような性質は、摂食中枢として知られる外側視床下部や、延髄のごく一部のニューロンが示すことは昔から知られていましたが、中脳にある黒質がなぜこのような性質をもつのか、その意義は明らかでありません。そこで現在、急性単離神経細胞や脳スライスのパッチクランプ法、イメージング法、さらに組織学的解析を組み合わせて、黒質ニューロンのグルコース低下感知機構を調べています。
また一部の黒質網様部ニューロンは、グルコース低下時に一過性に発火頻度を急激に増大させる現象をゆっくりとしたインターバルで繰り返すオシレーション現象を示すことも分かりました(Yuan, H. 他、Neurosci Lett 2004b)。私たちは黒質オシレーションの細胞機序についても、現在調べています。その意義について、黒質網様部は大脳基底核の出力核として運動制御の役割を果たすことから、運動制御信号の一種として機能するのではないかと想定しています。
このように黒質網様部ニューロンは低酸素のみならず、低グルコースも感知することから、脳内メタボリックセンサーとして機能しているのではないかと推定しています。その際、低酸素応答は生命に危機が及ぶぎりぎりの、極めてシビアな低酸素状態で、KATPチャネルを介してドラスティックな警戒信号を発するのに対して、低グルコース応答は、むしろ日常の空腹に相当するものと見られるわずかなグルコース低下に応答するようで、その機序も不明です。黒質の細胞活動は、摂食関連運動時に変化することがサルで報告されていますが、研究はまだこれからが本番です。
実は黒質のグルコース感受性の生理的意味を知る上では、脳内の正常グルコース濃度を知る事が重要です。しかし肝心の活動状態のニューロン近傍の細胞外グルコース濃度は明らかでありません。そこで私たちは現在まったく新しい原理に基づく脳内グルコースセンサーの開発の試みを行っています。
空腹は摂食行動という非常に強い欲求を呼び覚まします。極度の空腹がしばしば理性を失わせることは極限状態で繰り返し語られています。古い脳に属し、運動制御などに重要な役割を果たす中脳の黒質が摂食活動にリンクしているならば、本能と理性の関係を考える上で興味深いものがあります。また黒質の他にも、中脳には知られざる機能がたくさんあると私たちはみており、わくわくしながら研究を行っています。
黒質網様部は長い間、研究人口の少ない脳領域のひとつでした。一方隣接する黒質緻密部は、その主要構成細胞であるドーパミン細胞がモチベーションや報酬に関係し、その変性が難病パーキンソン病をもたらすことから、多くの研究があります。網様部と緻密部は組織学的にみると密接に関連しており、特に緻密部ニューロンが網様部に伸ばした「樹状突起」がドーパミンを樹状突起放出することが知られていますが、その放出機構や生理的意義ははっきりしていません。そこで私たちは網様部細胞とドーパミンとの関係を明らかにしていく研究も進めています。





